富士フイルム富山化学は、新型コロナウイルス感染症患者を対象とした抗インフルエンザウイルス薬「アビガン®錠」(一般名:ファビピラビル)(以下、アビガン)の国内臨床第Ⅲ相試験において、主要評価項目を達成したと発表した。
アビガンは、すでに国内では抗インフルエンザウイルス薬として製造販売承認を取得している薬剤。
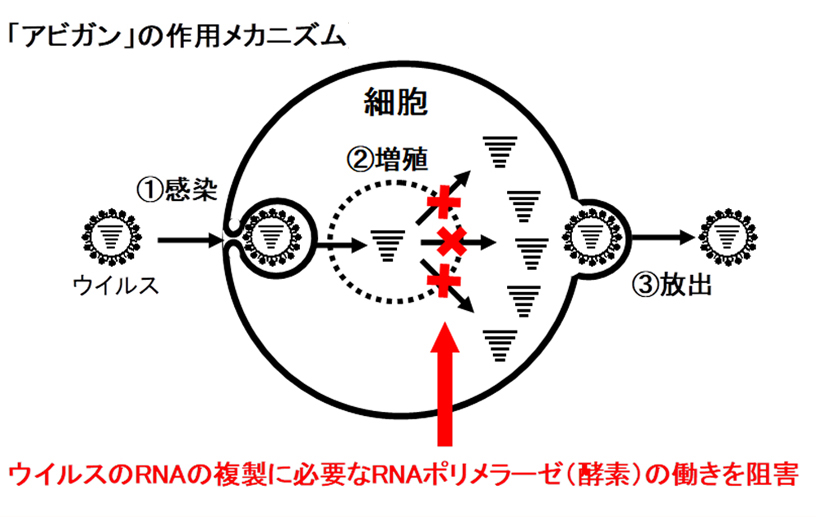
ウイルスのRNAポリメラーゼを選択的に阻害することでウイルスの増殖を防ぐというメカニズムを有していることから、インフルエンザウイルスと同種のRNAウイルスである新型コロナウイルスに対しても効果が期待されていたという。
こうした中、同社は、2020年3月、非重篤な肺炎を有する新型コロナウイルス感染症患者を対象に、アビガンの国内臨床第III相試験を開始。
症状(体温、酸素飽和度、胸部画像)の軽快かつウイルスの陰性化までの時間を主要評価項目として、「アビガン」投与の有効性と安全性をランダム化プラセボ対照単盲検比較試験で検討したとのことだ。
156例を解析対象とした主要評価項目の中央値は、アビガン投与群で11.9日、プラセボ投与群では14.7日となり、非重篤な肺炎を有する新型コロナウイルス感染症患者に、アビガンを投与することで早期に症状を改善することを、統計学的有意差(p値=0.0136)をもって確認できたとしている。
また、調整後ハザード比(※)は、1.593 (95%信頼区間1.024 – 2.479) を示したとのことだ。
今後、富士フイルム富山化学は、同試験の詳細なデータ解析および申請に必要な業務を迅速に進め、10月中にも「アビガン」の製造販売承認事項一部変更承認申請を行う予定であるとしている。
富士フイルムグループは、日本政府の備蓄増や海外からの提供要請に応えるために、国内外の企業と連携したアビガンの増産を進めている。今後、新型コロナウイルス感染症患者に一日も早く治療薬を届けることで、新型コロナウイルス感染症感染拡大の抑制や流行の終息に貢献するとしている。
(※)イベント発生の程度を相対的に比較する指標をハザード比といい、さらに比較群間の背景のズレを調整したものを調整後ハザード比という。本試験におけるハザード比は、症状の軽快かつウイルスの陰性化の起こりやすさを示した指標で、ハザード比が1より大きい場合には、「アビガン」投与の方が好ましいと判定される。







